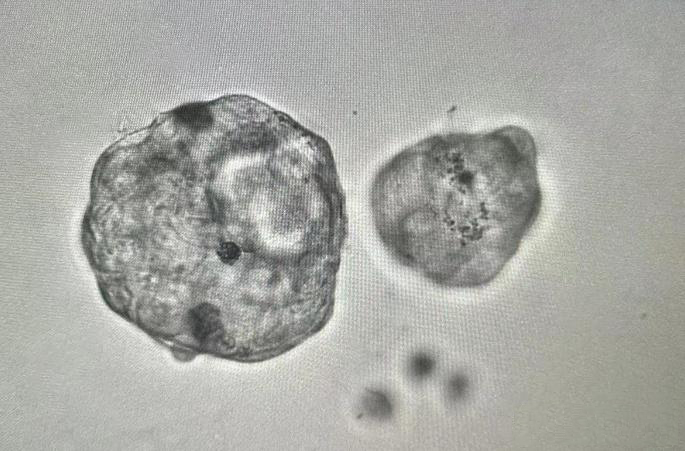
人外周血PBMC的CD4+ T细胞磁珠分选及流式鉴定
发布时间:2025-11-16
浏览次数:8075
作者:东极药物
一、实验原理病毒空斑实验主要基于病毒的感染和复制机制,当单个病毒感染细胞后,由于固体培养基的限制,病毒裂解细胞释放只能向周围细胞扩散。经过几个复制周期,便形成一个局限性病变细胞区,结晶紫使活细胞呈紫色···
一、实验原理
病毒空斑实验主要基于病毒的感染和复制机制,当单个病毒感染细胞后,由于固体培养基的限制,病毒裂解细胞释放只能向周围细胞扩散。经过几个复制周期,便形成一个局限性病变细胞区,结晶紫使活细胞呈紫色,而病变区细胞由于裂解死亡无法染色,形成空斑。通过观察空斑,可以揭示病毒的传播途径、寄主范围和致病机制。
二、实验步骤(以流感病毒感染MDCK细胞为例)
1.细胞铺板:MDCK细胞接种6孔板,2*10^6个细胞/孔。置于37℃,5%CO2培养箱培养48h。
2.病毒稀释:将病毒液用MEM(不含血清)按照10倍的梯度进行稀释,从10^ -1至10^ -8。
3.病毒接种:弃去细胞旧培养液,用PBS洗涤一次。每块6孔板设置两个对照组,每个浓度梯度设置两个实验组。对照组加入MEM,实验组每孔加入病毒稀释液1mL,置于35℃,5% CO2培养箱孵育1h。
4.配制2%琼脂培养基:A液:1g琼脂糖与50mL PBS溶液混合加热,使琼脂糖充分溶解,将温度降至70℃,待用。B液:准备37℃ MEM培养基50mL。
5.病毒固定:将A液和B液混合,加入1µg/mL TPCK-trypsin混匀;弃去病毒孵育液,每孔加入AB混合液2 mL;待其凝固后将6孔板倒扣放置35℃,5%CO2培养箱72h。培养完成后,每孔加入2mL的4%多聚甲醛固定液进行固定,时间大于4h。
6.空斑固定染色:去除甲醛固定液,去除6孔板中的固体琼脂培养基,用结晶紫染色液染色1 h,将多余的染色液冲洗干净,倒扣晾干。
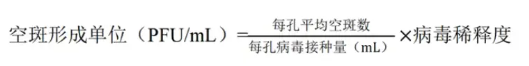
7.计算空斑数(PFU/mL):选择斑块清晰、不重叠、数量适中的孔,数出斑块数量,用以下公式进行计算。
三、注意事项
1.细胞铺板需要均匀,采用十字或八字摇法使细胞分布均匀,细胞培养完成后利用显微镜观察单层细胞密度是否达100%。
2.对病毒原液稀释时,需设置合理的梯度,在最低稀释度下,过多的感染性病毒粒子会破坏大片的单层细胞,或者产生过多且重叠的无法识别的空斑。
3.病毒孵育需用不含血清培养基。
4.琼脂糖半固体必须加入TPCK-trypsin,否则病毒无法进入细胞,形成噬斑。
5.将琼脂糖半固体加入孔板中,需注意琼脂糖温度。50℃左右最适宜,太高易导致细胞死亡,太低琼脂糖易凝固。
6.去除琼脂糖培养基时,注意避免刮到细胞,影响结果判断。
文章出自:验外实包 想了解更多请关注:http://www.dj-cro.com/